小林製薬の「紅麹」サプリを摂取していた人に健康被害が相次いでいる問題。これまでに5人が亡くなる事態になっています。入院生活を余儀なくされ、「一生治療が必要かもしれない」と不安に怯える女性が、その被害の実態を訴えました。
紅麹サプリ摂取後「すごい倦怠感、吐き気」、指摘された“薬害”の可能性
小林製薬のサプリを飲み続けたあとに体調が一変し、入院生活を余儀なくされたという女性が、報道特集の取材に応じた。
ーーこれが実際に飲まれていたサプリですか?
Aさん
「はい、途中まで飲んでいた」
ーーいつまで飲んでいた?
「入院する直前まで」

近畿地方に住む、Aさん(50代)がサプリを飲み始めたのは、2023年4月。人間ドックで“コレステロール値が高い”と指摘されたことがきっかけだった。

ーーこれを一日、何粒飲んでいた?
「3粒です。毎日」
ーーなぜ小林製薬の紅麹に?
「大手さんで心配ないかなと。まさか間違いがあると、これっぽっちも思っていませんでした」

製造番号(H306)のサプリは、入院症例が確認されたものだと小林製薬が公表している。
摂取を始めてから8か月後の2023年12月、Aさんは体調の異変を感じるようになっていた。
Aさん
「すごい倦怠感、1日24時間の吐き気。指を突っこんでも出ない、嘔吐はしない吐き気。たばこも吸うし、お酒も飲むんですけど、全く飲めなくなった」

休日には、趣味の書道や、車関連のイベントに参加するため、夫婦で全国各地を旅行していたというAさん。
その姿を傍で見続けてきた夫は・・・

Aさんの夫
「『吐き気がするから食べれへん』って言って、プリンとかヨーグルトとかだけ食べてたんですよ」
「夜の9時とか10時までは起きてたんですけど、どんどん早くなってきて、1月に入ったときは夜7時半には寝てたのでは」
2024年1月、尿に泡が立つようになり、ネットで調べたところ、腎臓機能の悪化が原因だと書かれていたため、クリニックに駆け込んだという。

Aさん
「(クレアチニンの)3.71という数値を見て、先生がびっくりされて『総合病院を紹介しますので、今すぐ行ってください』と」
血液中の老廃物・クレアチニンの数値が基準値(0.45~0.85)を大きく超え、腎臓の機能が低下していると告げられた。
総合病院を紹介され、そのまま入院することが決まった。
Aさん
「(クレアチニンの)数値が高いので、普通ではない。 もうちょっと数値が上に行くと、透析をしないといけなくなるような数値というのも伺ったので、かなりまずいことになっているんだなと思いました」
腎臓の精密検査を受けたAさんは、“薬害”の可能性を指摘されたという。
Aさん
「『何か服用されてましたか?何か点滴を受けられましたか?』って聞かれたんですけど、全く薬も飲んでなかった。『サプリを飲んでました』って。『これだけです』って、ドクターに一旦お渡ししたんです」
「何日間かお預かりされて『見る限りは大丈夫だとは思うんです。ただ、一旦飲まないでください』って止められました」
原因も分からないまま、Aさんは投薬治療を受けることになり、20日余り入院した。
健康被害の報告が複数あるも・・・小林製薬「これまでに同様の報告ない」

小林製薬は健康被害をいつ把握したのか。
小林製薬が健康被害を公表し、製品の自主回収を発表したのが3月22日。

しかし、摂取した人から最初に異変の報告を受けたのは、2024年1月11日、公表の2か月以上前だった。その4日後には医師からの連絡で、2人目の症例が判明。
2月1日には別の医師からも連絡があり、その後、公表まであわせて13人の症例について報告や問い合わせを受けていたという。
私たちは、小林製薬に連絡した医師の1人を訪ねた。
2月1日に合わせて3人の症例を小林製薬に伝えていた日本大学医学部の阿部医師。

2023年12月から2024年2月にかけて、サプリを飲んでいた3人の患者を診察した。
3人とも、腎臓の疾患により、尿に過剰なタンパクが排出されることで起きる「尿の泡立ち」がみられたという。

日本大学医学部 阿部雅紀医師
「紅麹のサプリを内服していたということが3人とも共通していましたので、過去にサプリで腎障害の事象がなかったかどうかという問い合わせを(小林製薬に)しました」
この時点で小林製薬には、摂取した人や医師から複数の報告が上がっていたが、小林製薬は阿部医師に対し「これまでに同様の報告はない」と回答したという。

ところがその後、連絡があり、2月22日に小林製薬が3人の病理検査の結果を聞きに来たと話す。
阿部医師
「薬剤性で生じるような、『尿細管間質性腎炎』の所見と説明させていただきましたので、2月22日の時点で、紅麹サプリの可能性が高いのではないか、我々もそして会社側も判断したのではないかなと」
Aさんが入院し、治療を始めたのは1月26日。

サプリが問題だと小林製薬の公表で知った。入院から約2か月が経過していた。
Aさん
「びっくりしました。これがやっぱり原因だったのかと」
——小林製薬の対応の遅さも問題だと?
「(対応は)大変遅い。私もそこは怒っています、憤慨しています。最終的な原因が分からないのはわかります。ただ、そのような被害が出ているということは公表すべきだったんじゃないかと」
対応の遅れについて、小林社長は・・・
小林製薬 小林章浩社長
「もう少し早く公表できれば防げたかと言われたら、その批判に対しては、私ども、言葉もございません。原因物質の特定にとにかく研究部門急ぎ、取り組んでもらっておりました」
——(阿部医師に)「同様の情報はない」と回答されている。なぜそういう回答をされたのか?
小林製薬 渡邊淳 執行役員
「途中で出ている症状において、共通の何か要因からきているものという認識が、まだこの時点の調査ではなかった」
——1月に事例があったにも関わらず、隠蔽したのでは?
「それは意図はありません」
医師「最悪 心停止も」 増えるサプリによる健康被害の問い合わせ

都内のクリニックでも、サプリの健康被害の問い合わせが増えている。
サプリを摂取した後に腎臓の機能が低下した患者について、症状が悪化すれば死に至る可能性があったと伊藤医師は指摘する。

いとう王子神谷内科外科クリニック 伊藤博道 院長
「最悪、心停止を起こします。手遅れになると体のむくみが出てきて食欲不振、吐き気、微熱、呼吸困難など出てくるわけですけど、腎臓の機能が悪くなったときに有害になるカリウムが溜まってしまうと心臓が止まってしまうんですよね」
今年1月以降、伊藤医師のクリニックでは問題のサプリを摂取していた患者は6人。
医師は小林製薬に対し・・・
伊藤院長
「複数名の医療機関、医師からのこのサプリメントが原因の可能性があるとなった時点で、フレキシブルに迅速に対応していただけたほうがよかったかなと思いますね」
「プべルル酸」以外の物質が健康被害に影響した可能性も

小林製薬は「紅麹」の成分を含むサプリメントから本来想定していない「プベルル酸」を検出したと明らかにした。
だが、厚生労働省は「プベルル酸」が健康被害の原因となったかどうか調査中だとしている。
わたしたちは問題があると指摘された製品とそれ以外の製品を研究室に持ち込み、検証を依頼した。

協力してもらったのは、昭和大学薬学部の佐藤均教授だ。

製造番号H306は、腎臓疾患の症状が出たAさんが持っていたもの。亡くなった人が購入していたこともわかっている。

そして問題が報告されていない2022年に製造されたサプリ=製造番号A201を同じ条件で調べる。
分析機器にかけると、含まれる成分は波形になって示される。
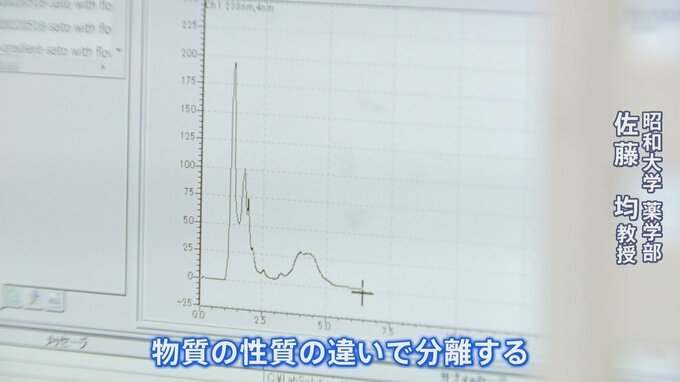
佐藤均教授
「物質の性質の違いで分離する。出てきた順に(波形の)ピークが出てくる」
もし、2つのサプリの成分が同じであればピークの位置はほぼ同じになるのだが、問題がないサプリはピークの数値が300程度であったのに対し、問題がある方は1500以上まで跳ね上がった。
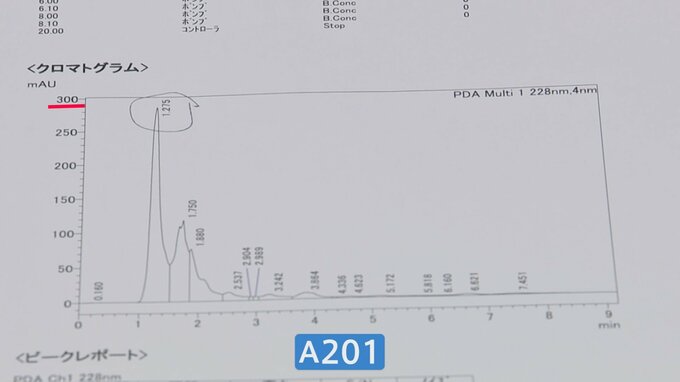

正確さを確認するため、3回繰り返した。その結果、Aさんが持っていたものの方が数値が高く出た。

佐藤教授
「要は含まれるものの量が、該当ロットの方が高い(多い)っていうことになると思います」
問題のサプリの方にはある成分が多く含まれることはわかったが、プべルル酸のサンプルがないためプべルル酸の特定はできない。
一方、佐藤教授は、プべルル酸以外の物質が健康被害に影響した可能性を指摘する。

紅麹の有効成分とされている「モナコリンK=ロバスタチン」という物質だ。実は海外で医薬品として使用されていて、副作用として腎機能障害が出ることが報告されている。
この物質が規制されず、日本でサプリとして販売された理由をこう語る。
佐藤教授
「本来ですと、医薬品として採用・認可されたものは、サプリメントとしては売れないんですね。もともと紅麹という昔から使われているものなので、そのまま通ってしまっているということで。本来ですと、最初からもっと注意しておくべき」

——入っている有効成分としては、薬と同じ?
「そう、薬と同じ」
——有効成分が同じってことは副作用も同じものが出てくる可能性が?
「もちろんです」
国の審査なし「機能性表示食品」現在約7000件 消費者庁は制度の在り方を検討

今回、問題となったサプリは、「機能性表示食品」に分類されている。
「機能性表示食品」は「特定保健用食品=トクホ」で義務づけられている国による安全性と機能性の審査が行われることはない。
事業者が科学的根拠を示す論文などを届け出れば、機能性を表示できるため、トクホと比べハードルは低い。

この制度が誕生したきっかけは、2013年6月にアベノミクスの「成長戦略」の一環で、閣議決定によって国の審査のない機能性表示を認める方針が決まった。
当時から安全性には疑問の声が上がっていた。

共産党 穀田恵二衆院議員
「どんな機能があるかというのは、企業任せで、機能性表示を認めようとしているものであります。かえって消費者トラブルを拡大することになりはしないか?」

森まさこ 消費者担当大臣(当時)
「安全性の確保を大前提とすることを申し上げております。消費者が困惑するような表示による消費者トラブルに繋がらないように制度設計をしてまいりたい」
穀田議員
「これは命に関わる問題ですから、起こってからでは遅いんですよ。私は危ないって言っていると、あなたは危険がないようにって言っていると、それは将来歴史がそれは審判するでしょう」
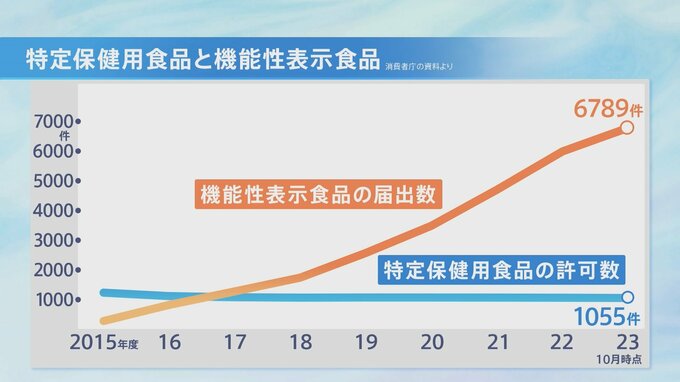
2015年、閣議決定から2年も経たずに制度が始まると機能性表示食品の届出数は増え続け、現在はトクホの7倍、約7000件にのぼっている。

当時、消費者団体から起用され消費者庁長官を務めた阿南久氏は、機能性表示食品制度は政権の既定路線で進められたと話す。

元消費者庁長官 阿南久氏
「トクホはとてもハードルが高い。中小事業者も参入できるようにすべきだという議論があって、参入しやすい制度を作りましょうと」
退任後、阿南氏はこの制度に第三者によるチェックが必要だと考え、民間の消費者団体を立ち上げた。
事業者が届け出た科学的根拠を評価し、公表する取り組みを行っている。

阿南氏
「A・B・C・保留と分けていて、Aは有効性について十分な科学的な根拠がある。Bは有効性についてかなりの科学的な根拠があるということになります」
事業者の協力も得ながら科学的根拠のもととなった論文の数など専門家の設定した基準で判定する。

2022年、小林製薬のサプリへの評価はCにとどまった。「有効性についてある程度の科学的根拠がある」とされた。
阿南氏
「(小林製薬は)健康被害が起こっているということを知った段階で公表すべき。機能性表示食品全体の命運に関わる問題。ダメにするようなことを事業者自身がしたら制度は潰れてしまうし、もっとしっかり自覚を高めて欲しい」

今回の問題を受け、消費者庁は、全ての機能性表示食品を緊急点検するとともに、制度の在り方について検討していくという。
鄭重声明:本文の著作権は原作者に帰属します。記事の転載は情報の伝達のみを目的としており、投資の助言を構成するものではありません。もし侵害行為があれば、すぐにご連絡ください。修正または削除いたします。ありがとうございます。



